पाठ्यक्रम: GS3/ अर्थव्यवस्था
संदर्भ
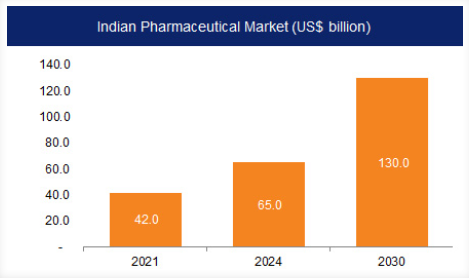
- वित्त वर्ष 2023-24 के लिए भारत का फार्मास्युटिकल बाजार 50 बिलियन अमेरिकी डॉलर का है, जिसमें घरेलू खपत 23.5 बिलियन अमेरिकी डॉलर एवं निर्यात 26.5 बिलियन अमेरिकी डॉलर का है।
भारत का फार्मास्युटिकल क्षेत्र
- भारत में दवा उद्योग मात्रा के मामले में विश्व में तीसरा सबसे बड़ा एवं मूल्य के मामले में 14 वाँ सबसे बड़ा है।
- उद्योग के प्रमुख क्षेत्रों में जेनेरिक दवाएँ, OTC दवाएँ, थोक दवाएँ, टीके, अनुबंध अनुसंधान और विनिर्माण, बायोसिमिलर एवं बायोलॉजिक्स सम्मिलित हैं।
- फार्मा क्षेत्र वर्तमान में देश के सकल घरेलू उत्पाद में लगभग 1.72% का योगदान देता है।
- भारत API का तीसरा सबसे बड़ा उत्पादक है, जिसकी वैश्विक API उद्योग में 8% हिस्सेदारी है।
भारत के फार्मास्युटिकल क्षेत्र की उपलब्धियाँ
- भारत वैश्विक वैक्सीन उत्पादन का 60% भाग है, जो डिप्थीरिया, टेटनस एवं काली खाँसी (DPT) और बैसिलस कैलमेट-गुएरिन (BCG) टीकों के लिए WHO की माँग का 70% तथा खसरे के टीके के लिए WHO की माँग का 90% योगदान देता है।
- भारत अफ्रीका की जेनेरिक दवाओं की 50% से अधिक आवश्यकता, अमेरिका में जेनेरिक माँग का ~40% और UK में सभी दवाओं का ~25% आपूर्ति करता है।
- ड्रग्स और फार्मास्यूटिकल्स उद्योग में संचयी FDI इक्विटी प्रवाह 2000-2024 की अवधि के दौरान US$ 22.52 बिलियन है, जो सभी क्षेत्रों में प्राप्त कुल प्रवाह का लगभग 3.4% है।
- देश वैश्विक स्तर पर जेनेरिक दवाओं का सबसे बड़ा प्रदाता है, जो मात्रा के हिसाब से वैश्विक आपूर्ति में 20% हिस्सेदारी रखता है, और वैश्विक स्तर पर अग्रणी वैक्सीन निर्माता है।
- भारत को अपनी दवाओं की कम लागत और उच्च गुणवत्ता के कारण “विश्व की फार्मेसी” के रूप में जाना जाता है।
भारत के फार्मास्युटिकल क्षेत्र के लिए चुनौतियाँ
- बौद्धिक संपदा (IP) संरक्षण: भारत के पेटेंट कानून, विशेष रूप से अनिवार्य लाइसेंसिंग एवं भारतीय पेटेंट अधिनियम की धारा 3 (d) के संबंध में, बहुराष्ट्रीय निगमों के साथ प्रायः विवादों को उत्पन्न कर देते हैं।
- आयात पर निर्भरता: APIs और प्रमुख प्रारंभिक सामग्री (KSMs) आयात निर्भरता उद्योग को आपूर्ति शृंखला व्यवधानों और मूल्य में उतार-चढ़ाव से संबंधित कमजोरियों को प्रकट करती है।
- कुशल मानव संसाधन: भारतीय दवा उद्योग को अनुसंधान एवं विकास को आगे बढ़ाने, संचालन का प्रबंधन करने और गुणवत्ता नियंत्रण सुनिश्चित करने के लिए अत्यधिक कुशल कार्यबल की आवश्यकता है।
- गुणवत्ता परीक्षणों में विफल होना: देश का फार्मा उद्योग राष्ट्रीय और अंतर्राष्ट्रीय पर्यवेक्षकों द्वारा व्यक्त की गई गुणवत्ता संबंधी चिंताओं को अत्यंत सीमा तक नकारता रहा है।
- 2014-2016 में केंद्रीय औषधि मानक नियंत्रण संगठन (CDSCO) के सर्वेक्षण के अनुसार, लगभग पाँच प्रतिशत भारतीय दवाएँ, जिनमें से कई बड़ी फार्मा कंपनियों द्वारा निर्मित हैं, गुणवत्ता परीक्षण में विफल रहीं।
सरकारी पहल
- फार्मास्यूटिकल्स के लिए उत्पादन से जुड़ी प्रोत्साहन (PLI) योजना 2020-21 से 2028-29 तक 15,000 करोड़ रुपये (2.04 बिलियन अमेरिकी डॉलर) के कुल परिव्यय के साथ कार्यान्वित की जा रही है।
- प्रधानमंत्री भारतीय जन औषधि परियोजना (PMBJP): समर्पित दुकानों के माध्यम से सभी को सस्ती कीमतों पर गुणवत्तापूर्ण जेनेरिक दवाइयाँ उपलब्ध कराई जाती हैं।
- ग्रीनफील्ड फार्मास्यूटिकल्स के लिए स्वचालित मार्ग के अंतर्गत फार्मास्युटिकल क्षेत्र में 100% प्रत्यक्ष विदेशी निवेश (FDI) की अनुमति है।
- फार्मास्यूटिकल्स विभाग ने राष्ट्रीय महत्त्व के संस्थानों के रूप में सात राष्ट्रीय फार्मास्यूटिकल शिक्षा और अनुसंधान संस्थान (NIPERs) स्थापित किए हैं, जो विभिन्न फार्मा विशेषज्ञताओं में उच्च स्तरीय अनुसंधान करते हैं।
- सरकार ने फार्मास्यूटिकल्स और चिकित्सा उपकरणों में अनुसंधान एवं विकास को प्रोत्साहित करने के लिए 2023 में “भारत में फार्मा-मेडटेक क्षेत्र में अनुसंधान एवं विकास तथा नवाचार पर राष्ट्रीय नीति” तैयार की है।
- पेटेंट नियम: 2014 से, पेटेंट आवेदनों की फाइलिंग और प्रसंस्करण को सुव्यवस्थित एवं सरल बनाने, अनियमितताओं को दूर करने, प्रक्रियागत विलंब का निवारण करने तथा पेटेंट देने की प्रक्रिया में जटिलताओं को दूर करने के लिए पेटेंट नियमों में कई बार संशोधन किया गया है।
- स्टार्ट-अप बौद्धिक संपदा संरक्षण (SIPP) योजना भारत में स्थापित प्रौद्योगिकी और नवाचार सहायता केंद्रों (TISCs) की सेवाओं का उपयोग करने वाले इच्छुक स्टार्टअप तथा सभी भारतीय नवप्रवर्तकों द्वारा पेटेंट, ट्रेडमार्क एवं डिजाइन की सुरक्षा की सुविधा प्रदान करती है।
आगे की राह
- भारत में दवा उद्योग देश के विदेशी व्यापार का एक महत्त्वपूर्ण हिस्सा है और निवेशकों के लिए आकर्षक संभावनाएँ प्रदान करता है।
- जेनेरिक दवाओं को बाजार में तेजी से प्रस्तुत करने पर ध्यान केंद्रित किया गया है और इससे भारतीय दवा कंपनियों को लाभ मिलने की संभावना है।
- इसके अतिरिक्त, ग्रामीण स्वास्थ्य कार्यक्रमों, जीवन रक्षक दवाओं और निवारक टीकों पर बल भी दवा कंपनियों के लिए अच्छा संकेत है।
| नई औषधि और क्लिनिकल परीक्षण नियम, 2019 – 90 दिनों की अवधि के अंदर अनुमोदन या अस्वीकृति या आगे की जानकारी प्राप्त करके नैदानिक परीक्षण और नई दवा के आवेदनों का निपटान। – भारत में दवा की खोज, अनुसंधान एवं निर्माण के हिस्से के रूप में एक नई दवा या जाँच नई दवा के नैदानिक परीक्षण के संचालन के लिए आवेदन के मामले में, आवेदन को 30 दिनों की अवधि के अंदर निपटाया जाना है। – कुछ स्थितियों जैसे कि अपूर्ण आवश्यकता, दुर्लभ बीमारियों के लिए ओर्फेन दवाओं आदि में त्वरित / शीघ्र अनुमोदन प्रक्रिया के लिए प्रावधान। – औपचारिक चर्चा एवं मामले के विशिष्ट नियामक मार्ग के लिए CDSCO के साथ आवेदकों की पूर्व-प्रस्तुति और प्रस्तुति के बाद की बैठकों के लिए प्रावधान। |
Source: PIB
Previous article
सरकार ने नो-डिटेंशन पॉलिसी समाप्त की
Next article
भारत के कच्चे तेल के भंडार